
1.1 Struktur Atom
Anda tentu masih ingat dengan model atom yang dikemukakan oleh Ernest
Rutherford (1871–1937)
dan dilengkapi oleh Niels Bohr (1885 – 1962) yang
menerangkan bahwa elektron-elektron mengelilingi inti atom pada tingkat-tingkat
energi tertentu yang disebut kulit atom. Pada bab ini, kita akan mempelajari
pengembangan model atom modern berdasarkan konsep mekanika gelombang.
A. Teori Kuantum Max Planck
Max Planck, ahli fisika dari Jerman, pada tahun 1900 mengemukakan
teori kuantum. Planck menyimpulkan bahwa atom-atom dan molekul dapat
memancarkan atau menyerap energi hanya dalam jumlah tertentu. Jumlah atau
paket energi terkecil yang dapat dipancarkan atau diserap oleh atom atau
molekul dalam bentuk radiasi elektromagnetik disebut kuantum.
Planck menemukan bahwa energi foton (kuantum) berbanding lurus dengan
frekuensi cahaya.
E = h ·
dengan: E = energi (J)
h = konstanta Planck 6,626 × 10–34 J. s
= frekuensi radiasi (s–1)
Salah satu fakta yang mendukung kebenaran dari teori kuantum Max Planck
adalah efek fotolistrik, yang dikemukakan oleh Albert Einstein pada tahun
1905. Efek fotolistrik adalah keadaan di mana cahaya mampu mengeluarkan
elektron dari permukaan beberapa logam (yang paling terlihat adalah logam
alkali) (James E. Brady, 1990).
Susunan alat yang dapat menunjukkan efek fotolistrik ada pada gambar
1.1. Elektrode negatif (katode) yang ditempatkan dalam tabung vakum terbuat
dari suatu logam murni, misalnya sesium. Cahaya dengan energi yang cukup
dapat menyebabkan elektron terlempar dari permukaan logam.
Elektron tersebut akan tertarik ke kutub positif (anode) dan
menyebabkan aliran listrik melalui rangkaian tersebut.
Einstein menerangkan bahwa cahaya terdiri dari partikel-partikel foton
yang energinya sebanding dengan frekuensi cahaya. Jika frekuensinya rendah,
setiap foton mempunyai jumlah energi yang sangat sedikit dan tidak mampu
memukul elektron agar dapat keluar dari permukaan logam. Jika frekuensi
(dan energi) bertambah, maka foton memperoleh energi yang cukup untuk
melepaskan elektron (James E. Brady, 1990). Hal ini menyebabkan kuat arus
juga akan meningkat.
Energi foton bergantung pada frekuensinya.
E = h · atau E = h ⋅ c
λ
dengan: h = tetapan Planck (6,626 × 10–34 J dt)
= frekuensi (Hz)
c = kecepatan cahaya dalam vakum (3 × 108 m det–1)
λ = panjang gelombang (m)
B. Model Atom Bohr
Pada tahun 1913, Niels Bohr menggunakan
teori kuantum untuk menjelaskan spektrum unsur.
Bohr memilih hidrogen sebagai model untuk
teorinya, hal ini mudah dimengerti karena hidrogen
mempunyai atom yang paling sederhana (satu proton
dan satu elektron)(James E. Brady, 1990).
Berdasarkan pengamatan diketahui bahwa
unsur-unsur menghasilkan spektrum garis di mana
tiap unsur mempunyai spektrum yang khas. Menurut
Bohr, spektrum garis menunjukkan bahwa elektron dalam atom hanya dapat
beredar pada lintasan-lintasan dengan tingkat energi tertentu. Pada lintasan
itu, elektron dapat beredar tanpa pemancaran atau penyerapan energi. Lintasan
elektron tersebut berupa lingkaran dengan jari-jari tertentu yang disebut sebagai
kulit atom.
Pada keadaan normal, elektron akan mengisi kulit-kulit dengan tingkat
energi terendah, yaitu dimulai dari kulit K, L, dan seterusnya. Keadaan di
mana elektron mengisi kulit-kulit dengan tingkat energi terendah disebut tingkat
dasar (ground state). Jika atom mendapat energi dari luar (misalnya dipanaskan,
diberi beda potensial), maka elektron akan menyerap energi yang sesuai
sehingga berpindah ke tingkat energi yang lebih tinggi. Keadaan di mana ada
elektron yang menempati tingkat energi yang lebih tinggi disebut keadaan
tereksitasi (excited state).
Perpindahan elektron dari tingkat energi lebih rendah ke tingkat energi
lebih tinggi disertai penyerapan energi. Sebaliknya, perpindahan elektron dari
tingkat energi lebih tinggi ke tingkat energi lebih rendah disertai pelepasan
energi, yaitu berupa radiasi elektromagnet. Elektron dapat berpindah dari satu
lintasan ke lintasan lain disertai pemancaran atau penyerapan sejumlah tertentu
energi, yang harganya sama dengan selisih kedua tingkat energi tersebut.
ΔE = Ef – Ei
dengan: ΔE = energi yang menyertai perpindahan elektron (joule)
Ef = tingkat energi akhir (joule)
Ei = tingkat energi mula-mula (joule)
Dari percobaan yang dilakukan, Bohr merumuskan sebagai berikut.
1. Elektron bergerak mengelilingi inti atom dengan lintasan (orbit) tertentu,
dengan momen sudut kelipatan dari 2
h ⋅ h = ketetapan Planck.
2. Selama elektron bergerak pada lintasannya, maka energinya akan tetap,
sehingga tidak memancarkan energi.
3. Selama bergerak mengelilingi inti, elektron dapat berpindah naik atau turun
dari satu lintasan ke lintasan yang lain.
Karena perpindahan elektron berlangsung antara kulit yang sudah tertentu
tingkat energinya, maka atom hanya akan memancarkan radiasi dengan tingkat
energi yang tertentu pula. Dengan demikian dapat dijelaskan penyebab
spektrum unsur berupa spektrum garis. Bohr menggunakan atom hidrogen
sebagai model, dan dia berhasil merumuskan jari-jari lintasan dan energi
elektron.
Jari-jari lintasan ke-n dalam atom hidrogen memenuhi rumus:
rn = n2a0
dengan: n = kulit ke-1, 2, dan seterusnya
a0 = 0,53 Å (53 pm) ⎯⎯→ (1 pm = 10–12 m)
Energi elektron pada lintasan ke-n adalah:
H
n 2
E = – R
n
dengan: RH = tetapan (2,179 × 10–18 J)
Teori atom Bohr berhasil diterapkan
untuk atom hidrogen, akan tetapi
tidak dapat digunakan untuk
memperkirakan spektrum atom
lain (yang mempunyai elektron
lebih dari satu)
(James E. Brady, 1990).
Menurut Heisenberg, metode eksperimen apa saja yang digunakan untuk
menentukan posisi atau momentum suatu partikel kecil dapat menyebabkan
perubahan, baik pada posisi, momentum, atau keduanya. Jika suatu percobaan
dirancang untuk memastikan posisi elektron, maka momentumnya menjadi
tidak pasti, sebaliknya jika percobaan dirancang untuk memastikan momentum
atau kecepatan elektron, maka posisinya menjadi tidak pasti.
Untuk mengetahui posisi dan momentum suatu elektron yang memiliki
sifat gelombang, maka pada tahun 1927, Erwin Schrodinger, mendeskripsikan
pada sisi elektron tersebut dengan fungsi gelombang (wave function) yang
memiliki satu nilai pada setiap posisi di dalam ruang (Oxtoby, Gillis, Nachtrieb).
Fungsi gelombang ini dikembangkan dengan notasi ϕ (psi), yang menunjukkan
bentuk dan energi gelombang elektron (James E. Brady, 1990).
Model atom mekanika kuantum menerangkan bahwa elektron-elektron
dalam atom menempati suatu ruang atau “awan” yang disebut orbital, yaitu
ruang tempat elektron paling mungkin ditemukan. Beberapa orbital bergabung
membentuk kelompok yang disebut subkulit. Jika orbital kita analogikan
sebagai “kamar elektron”, maka subkulit dapat dipandang sebagai “rumah
elektron”. Beberapa subkulit yang bergabung akan membentuk kulit atau “desa
elektron”.
Satu kulit tersusun dari subkulit-subkulit
Satu subkulit tersusun dari orbital-orbital
Satu orbital menampung maksimal dua elektron
Orbital-orbital dalam satu subkulit mempunyai tingkat energi yang sama,
sedangkan orbital-orbital dari subkulit berbeda, tetapi dari kulit yang sama
mempunyai tingkat energi yang bermiripan.
4. Bilangan Kuantum Spin (ms atau s)
Sambil beredar mengintari inti, elektron juga berputar pada sumbunya.
Gerak berputar pada sumbu ini disebut rotasi. Hanya ada dua kemungkinan
arah rotasi elektron, yaitu searah atau berlawanan arah jarum jam. Kedua
arah yang berbeda itu dinyatakan dengan bilangan kuantum spin (s) yang
mempunyai nilai s = + 2
1
atau s = – 2
1
. Akibatnya satu orbital hanya dapat
ditempati oleh maksimum dua elektron, di mana kedua elektron itu haruslah
mempunyai spin yang berlawanan, sehingga menghasilkan medan magnet
yang berlawanan pula. Medan magnet yang berlawanan ini diperlukan untuk
mengimbangi gaya tolak-menolak listrik yang ada (karena muatan sejenis).
Dapat disimpulkan bahwa kedudukan suatu elektron dalam suatu atom
dinyatakan oleh empat bilangan kuantum, yaitu:
a. Bilangan kuantum utama (n) menyatakan kulit utamanya.
b. Bilangan kuantum azimuth (l) menyatakan subkulitnya.
c. Bilangan kuantum magnetik (m) menyatakan orbitalnya.
d. Bilangan kuantum spin (s) menyatakan spin atau arah rotasinya.
Ada beberapa hal yang perlu diperhatikan, yaitu:
a. Sampai saat ini, elektron-elektron baru menempati subkulit-subkulit s,
p, d, dan f. Sedangkan subkulit g, h, dan i belum terisi elektron.
b. Setiap kulit mengandung subkulit sebanyak nomor kulit dan dimulai dari
subkulit yang paling sedikit orbitalnya. Kulit pertama hanya mengandung
subkulit s; kulit ke-2 mengandung s dan p; kulit ke-3 mengandung subkulit
s, p, dan d; dan seterusnya.
F. Bentuk dan Orientasi Orbital
Energi dan bentuk orbital diturunkan dari persamaan gelombang (ϕ = psi),
sedangkan besaran pangkat dua (ϕ2) dari persamaan gelombang menyatakan
rapatan muatan atau peluang menemukan elektron pada suatu titik dan jarak
tertentu dari inti. Bentuk orbital tergantung pada bilangan kuantum azimuth
(l), artinya orbital dengan bilangan kuantum azimuth yang sama akan
mempunyai bentuk yang sama. Orbital 1s, 2s, dan 3s akan mempunyai bentuk
yang sama, tetapi ukuran atau tingkat energinya berbeda.
1. Orbital s
Orbital yang paling sederhana untuk dipaparkan adalah orbital 1s.
Gambar 1.6 menunjukkan tiga cara pemaparan orbital 1s. Gambar menunjukkan
bahwa rapatan muatan maksimum adalah pada titik-titik di sekitar
(dekat) inti. Rapatan berkurang secara eksponen dengan bertambahnya jarak
dari inti. Pola bercak-bercak (gambar) secara jelas menunjukkan bahwa
rapatan muatan meluas secara simetris ke semua arah dengan jarak
antarbercak yang berangsur meningkat. Secara teori peluang, untuk menemui
elektron tidak pernah mencapai nol. Oleh karena itu tidak mungkin
menggambarkan suatu orbital secara lengkap. Biasanya gambar orbital
dibatasi, sehingga mencakup bagian terbesar (katakanlah 90%) peluang
menemukan elektron. Gambar 1.6(c) adalah orbital 1s dengan kontur 90%.
Dalam teori atom modern, jari-jari atom didefinisikan sebagai jarak dari
inti hingga daerah dengan peluang terbesar menemukan elektron pada orbital
terluar. Bentuk dan orientasi orbital 2s diberikan pada gambar. Sama dengan
orbital 1s, rapatan muatan terbesar adalah pada titik-titik sekitar inti. Rapatan
menurun sampai mencapai nol pada jarak tertentu dari inti. Daerah tanpa
peluang menemukan elektron ini disebut simpul. Selanjutnya, rapatan muatan
elektron meningkat kembali sampai mencapai maksimum, kemudian secara
bertahap menurun mendekati nol pada jarak yang lebih jauh. Peluang terbesar
menemukan elektron pada orbital 2s adalah pada awan lapisan kedua.
Sedangkan untuk orbital 3s juga mempunyai pola yang mirip dengan orbital
2s, tetapi dengan 2 simpul. Kontur 90% dari orbital 3s ditunjukkan pada
gambar 1.6(b), di mana peluang untuk menemukan elektron pada orbital 3s
adalah pada awan lapisan ketiga.

2. Orbital p
Rapatan muatan elektron orbital 2p adalah nol pada inti (gambar 1.7),
meningkat hingga mencapai maksimum di kedua sisi, kemudian menurun
mendekati nol seiring dengan bertambahnya jarak dari inti. Setiap subkulit
p ( = 1) terdiri dari tiga orbital yang setara sesuai dengan tiga harga m
untuk = 1, yaitu -1, 0, dan +1. Masing-masing diberi nama px, py, dan pz
sesuai dengan orientasinya dalam ruang. Kontur yang disederhanakan dari
ketiga orbital 2p diberikan pada gambar 1.7.(c). Distribusi rapatan muatan
elektron pada orbital 3p ditunjukkan pada gambar 1.7.(b). Sedangkan kontur
orbital 3p dapat juga digambarkan seperti gambar 1.7.(a) (seperti balon
terpilin), tetapi ukurannya relatif lebih besar.

Orbital dengan bilangan azimuth l = 2, yaitu orbital d, mulai terdapat
pada kulit ketiga (n = 3). Setiap subkulit d terdiri atas lima orbital sesuai
dengan lima harga m untuk l = 2, yaitu m = –2, –1, 0, +1, dan +2. Kelima
orbital d itu diberi nama sesuai dengan orientasinya, sebagai x2 – x2 d , dxy, dxz,
dyz, dan z d 2 . Kontur dari kelima orbital 3d diberikan pada gambar 1.8 dan
1.9. Walaupun orbital z d 2 mempunyai bentuk yang berbeda dari empat orbital
d lainnya, tetapi energi dari kelima orbital itu setara.
Orbital f lebih rumit dan lebih sukar untuk
dipaparkan, tetapi hal itu tidaklah merupakan
masalah penting. Setiap subkulit f terdiri atas 7
orbital, sesuai dengan 7 harga m untuk l = 3.

Suatu cara penulisan yang menunjukkan distribusi elektron dalam orbitalorbital
pada kulit utama dan subkulit disebut konfigurasi elektron. Pada
penulisan konfigurasi elektron perlu dipertimbangkan tiga aturan (asas), yaitu
prinsip Aufbau, asas larangan Pauli, dan kaidah Hund.
1. Prinsip Aufbau
Elektron-elektron dalam suatu atom
berusaha untuk menempati subkulitsubkulit
yang berenergi rendah, kemudian
baru ke tingkat energi yang lebih tinggi.
Dengan demikian, atom berada pada
tingkat energi minimum. Inilah yang
disebut prinsip Aufbau.
Urutan-urutan tingkat energi ditunjukkan
pada gambar 1.11.
Jadi, pengisian orbital dimulai dari
orbital 1s, 2s, 2p, dan seterusnya. Pada
gambar dapat dilihat bahwa subkulit 3d
mempunyai energi lebih tinggi daripada
subkulit 4s. Oleh karena itu, setelah 3p
terisi penuh maka elektron berikutnya
akan mengisi subkulit 4s, baru kemudian
akan mengisi subkulit 3d.

Untuk menyatakan distribusi elektron-elektron pada orbital-orbital
dalam suatu subkulit, konfigurasi elektron dapat dituliskan dalam bentuk
diagram orbital. Suatu orbital dilambangkan dengan strip, sedangkan dua
elektron yang menghuni satu orbital dilambangkan dengan dua anak panah
yang berlawanan arah. Jika orbital hanya mengandung satu elektron, anak
panah dituliskan mengarah ke atas.
Dalam kaidah Hund, dikemukakan oleh Friedrich Hund (1894 – 1968)
pada tahun 1930, disebutkan bahwa elektron-elektron dalam orbital-orbital
suatu subkulit cenderung untuk tidak berpasangan. Elektron-elektron baru
berpasangan apabila pada subkulit itu sudah tidak ada lagi orbital kosong.
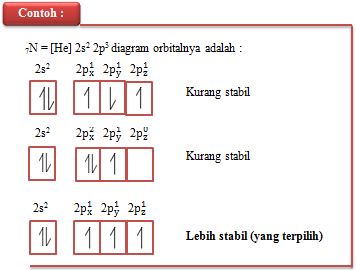
Pada tahun 1928, Wolfgang Pauli (1900 – 1958) mengemukakan bahwa
tidak ada dua elektron dalam satu atom yang boleh mempunyai keempat
bilangan kuantum yang sama. Dua elektron yang mempunyai bilangan
kuantum utama, azimuth, dan magnetik yang sama dalam satu orbital, harus
mempunyai spin yang berbeda. Kedua elektron tersebut berpasangan.
Setiap orbital mampu menampung maksimum dua elektron. Untuk
mengimbangi gaya tolak-menolak di antara elektron-elektron tersebut, dua
elektron dalam satu orbital selalu berotasi dalam arah yang berlawanan.
Subkulit s (1 orbital) maksimum 2 elektron
Subkulit p (3 orbital) maksimum 6 elektron
Subkulit d (5 orbital) maksimum 10 elektron
Subkulit f (7 orbital) maksimum 14 elektron
Tidak ada komentar:
Posting Komentar